AdvanceCOR
Pipeline
Product Pipeline
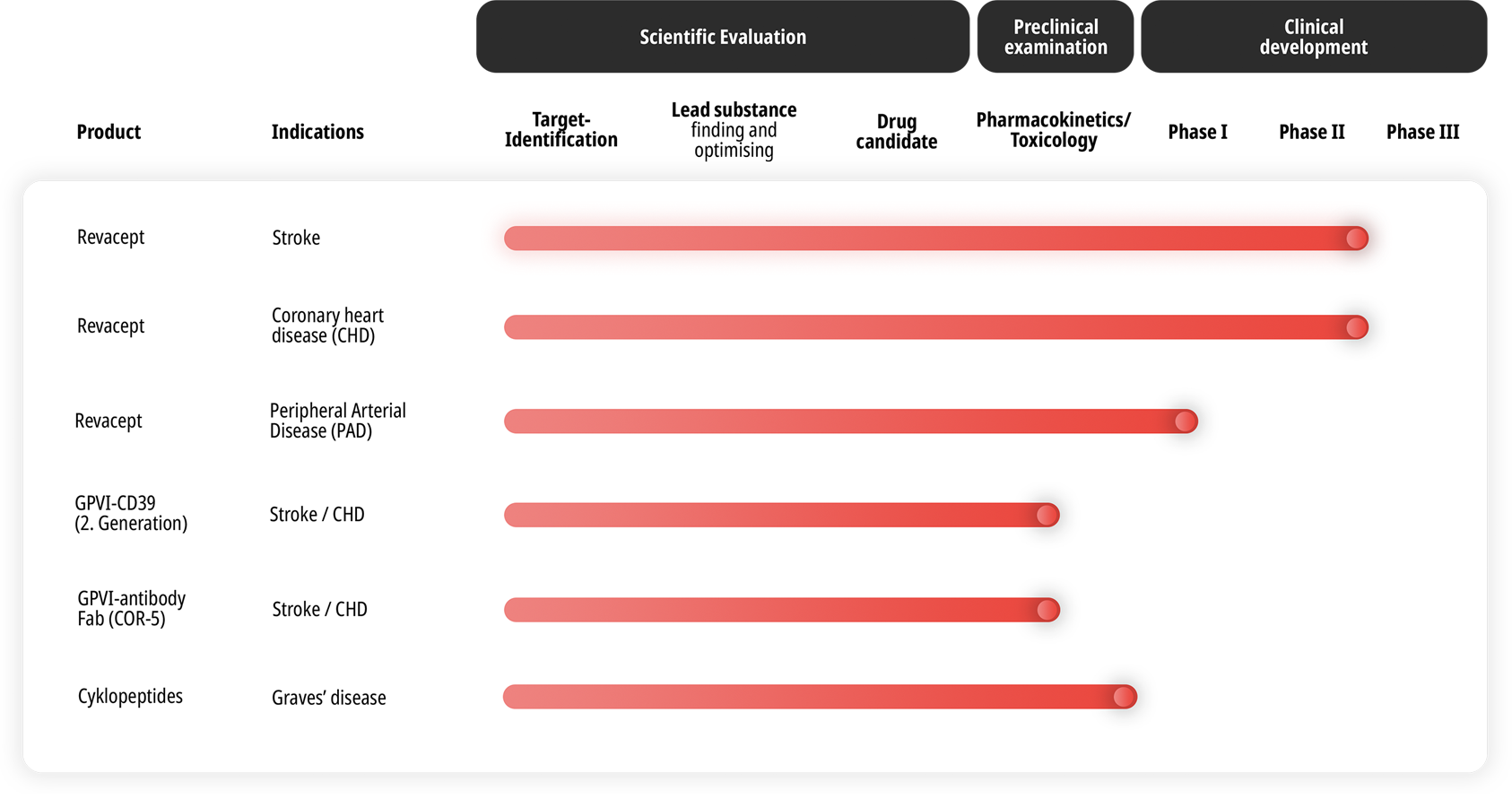
Our drug candidates at a glance
Revacept, a therapeutic agent for the prevention and treatment of acute arterial thrombosis, which can lead to heart attack, acute limb ischemia and stroke. It showed specific efficacy in patients and was very well tolerated.
- A Phase II clinical trial in 160 patients with stroke or transient ischaemic attack (TIA) has been completed. It showed beneficial effects in patients treated with 120 milligrams (mg) of Revacept.
- Another Phase II clinical trial investigated Revacept in 332 patients with stable coronary artery disease (ISAR-PLASTER) has been completed. This study conducted by the German Centre for Cardiovascular Research (DZHK) confirmed the very good tolerability of Revacept. In particular, Revacept did not lead to increased bleeding despite of its additional platelet aggregation inhibition on top of the inhibition induced by conventional standard therapy.
Second generation anti-thrombotic therapies combining the effect of Revacept (competitive GPVI antagonism) and the ADP ase actitivity from CD39.
GPVI-CD39 inhibits both the local plaque-mediated collagen and the local ADP mediated thrombus formation. The ADPase activity of CD39 local abolished the ADP-mediated thrombus formation
In collaboration with Morphosys an anti-GPVI Fab antibody has been discovered for the more potent inhibition of GPVI-mediated thrombus formation.
The candidate is currently in preclinical evaluation for the treatment of acute coronary syndrome and stroke.
Novel, antigen-specific inhibition of autoimmune mechanisms are addressed with specific cyclic peptides derived from the Thyrotropin (TSH) Receptor. By restoring immune tolerance the auto-immune inflammation of the thyroid also called Graves disease can be specifically interrupted. The novel peptide is currently in preclinical evaluation.
advancecor therapeutic agents for prevention and treatment of acute arterial thrombosis
advancecor therapeutic agents for prevention and treatment of acute arterial thrombosis
Our drug
candidates in detail
Revacept
Therapeutic agent for the prevention and treatment of acute arterial thrombosis.
GPVI-inhibitory
antibodies
Preventing the activation of blood platelets, protecting against heart attacks and strokes.
Cyclopeptides against
hyperthyroidism
Graves’ disease is a severe thyroid disease. It causes the thyroid gland to become overactive: too much thyroid hormone (TSH) is produced, which disrupts numerous organ functions.

